Dalam termodinamika ada dua istilah yang familiar yaitu sistem dan lingkungan. Sistem adalah sejumlah gas dalam benda dengan volume tertutup. Lingkungan adalah benda-benda yang berada diluar sisitem.
Kesetaraan Kalor dan Energi
Energi kekal, tidak dapat dimusnahkan
atau diciptakan, tetapi dapat diubah dari satu bentu ke bentuk yang
lain. Kalor adalah salah satu bentuk energi. Kesetaraan kalor dalam termodinamika dirumuskan
1 Kalori = 4,186 Joule= 4,2 Joule
1 Joule = 0,24 Kalori
1 Joule = 0,24 Kalori
Gas yang Dipengaruhi Usaha dari Lingkungannya
Gaya sebesar F yang diperlukan oleh piston yang mempunyai luas penampang A untuk menekan gas di dalam ruang tertutup sebesar p dirumuskan
F = pA
Besarnya usaha yang dilakukan oleh gas adalah
W = pA (h2-h1)
oleh karena A (h2-h1) adalah volume maka dapat disederhanakan
W = p (V2-V1) atau W = p ΔV
dengan
V1 = volume mula-mula
V2 = volume akhir
ΔV = perubahan volume
W = usaha luar yang diterima
p = tekanan gas
Bila W > 0 → sistem melakukan usaha (V2 > V1)
Bila W < 0 → sistem menerima usaha dari lingkungan (V2 < V1)
Perlu sobat ketahui bahwa usaha luar yang dialami oleh gas ideal ada 4 jenis yaitu:
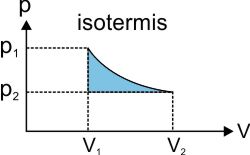
:: Proses Isotermis (Suhu Konstan)
Usaha luar ga (W) sebanding dengan luas daerah di bawah kurva, rumusnya
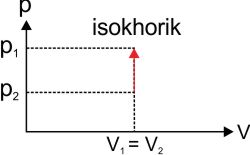
:: Proses Isokhorik (Volume Konstan)
W = p ΔV
karena volume konstan maka ΔV = 0 sehingga
W = 0
W = 0
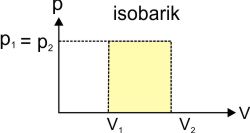
:: Proses Isobarik
W = p ΔV = p (V2-V1)
:: Proses Adiabatik
Yang dimaksud proses adibatik adalah
proses perubahan sistem tqanpa ada kalor yang masuk atau keluar dari
atau ke dalam sistem. Pada proses adiabatik berlaku persamaan:
p V γ = tetap ; γ = Cp/Cv
γ = tetapan laplace
Cp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
karena sistem tidak melepas atau menerima kalor maka usaha yang
dilakukan oleh sistem hanya untuk merubah energdalam yang besaranya
dapat dirumuskanCp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
W = 1/(γ-1) x (P1 V1 – P2 V2)
Rumus Menentukan Usaha Luar menggunakan Grafik
Usaha luar yang dilakukan oleh gas pada
tekanan tidak tetap dapat dinyatakan dalam diagrar p-V, yang besarnya
sebanding dengan luas daerah di awah kurva
a. Proses ke arah kanan
V2 > V1, berarti W bernilai positif
W = p (V2-V1)
b. Proses Kearah Kiri
W = -p (V2-V1)
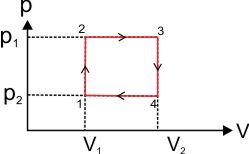
c. Proses Berbentuk Siklus
Proses 2 ke 3(ke kanan) → W = positif
Proses 3 ke 4 → W = 0
Proses 4 ke 1 (ke kiri) → W = negatif
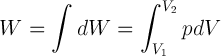
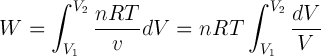
No comments:
Post a Comment