Bentuk-Bentuk Molekul dan Hibridisasinya
|
Domain Elektron
|
PEI
|
PEB
|
Hibridisasi
|
Tipe
Molekul |
Bentuk
Molekul |
Contoh
|
|
2
|
2
|
0
|
sp
|
AX2
|
linier
|
BeCl2
|
|
3
|
3
|
0
|
sp2
|
AX2
|
Segi tiga sama sisi
|
BCl3
|
|
2
|
1
|
sp2
|
AX2E
|
sudut
|
SO2
|
|
|
4
|
4
|
0
|
Sp3
|
AX4
|
Tetra hedral
|
CH4
|
|
3
|
1
|
Sp3
|
AX3E
|
Trigonal piramida
|
NH3 ; PCl3
|
|
|
2
|
2
|
Sp3
|
AX2E2
|
Bentuk V
|
H2O
|
|
|
5
|
5
|
0
|
Sp3d
|
AX5
|
Trigonal bipiramida
|
PCl5
|
|
3
|
2
|
Sp3d
|
AX3E2
|
Bentuk T
|
IF3
|
|
|
2
|
3
|
Sp3d
|
AX2E3
|
linier
|
XeF2
|
|
|
6
|
6
|
0
|
Sp3d2
|
AX6
|
oktahedral
|
SF6
|
|
4
|
2
|
Sp3d2
|
AX4E2
|
Segiempat planar
|
XeF4
|
|
|
5
|
1
|
Sp3d2
|
AX5E
|
Piramida segiempat
|
IF5
|
Untuk Lebih Jelasnya Mengenai hibridisasi ini mari sobat kita lihat bersama contoh berikut:
BCl3 (senyawa Boron Triclorida)
Daari senyawa di atas unsur yang menjadi
unsur pusat yaitu B (Boron). Maka, B yag memiliki nomor atom 5,
kemudian elektron dikonfigurasikan.
5B = 1s2 , 2s2, 2p1
Elektron valensi = 35B = 1s2 , 2s2, 2p1
Dari konfigurasi elektron di atas kita dapat digambarkan diagram orbital awal dari elektron valensi Boron adalah
2s2, 2p1

Orbital di atas belum mengalami
hibridisasi. Kemudia untuk dapat memasankan elektron pada boron dengan
elektro dari atom kloring diperlukan 3 buah elektron yang tidak
berpasangan. Nah untuk mendapatkan 3 elektron tidak berpasangan inilah
dilakukan perpindahan elektron dari orbital yang disebut hibridisasi.
Berikut diagram orbital atom boron setelah hibridisasi
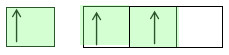 Dari diagram di atas terjadi hibridisasi yang terdiri dari orbital s dan orbital p yang awalnya sp1 menjadi sp2 dan menghasilkan molekul berbentuk segitiga sama sisi. Buat menambah pemahaman sobat kita ulas lagi satu contoh berikut:
Dari diagram di atas terjadi hibridisasi yang terdiri dari orbital s dan orbital p yang awalnya sp1 menjadi sp2 dan menghasilkan molekul berbentuk segitiga sama sisi. Buat menambah pemahaman sobat kita ulas lagi satu contoh berikut:Hibridisasi dalam molekul PCl5
molekul PCl5 diketahui berbentuk bipiramida trigonal. Atom phosfor (nomor atom =15)
mempunyai konfigurasi elektron sebagai berikut.
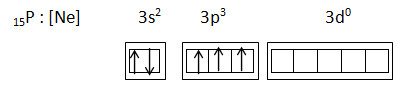
15P : [Ne] 3s2 3p3
Supaya dapat membentuk 5 ikatan kovalen,
maka 1 elektron dari orbital 3s harus dipromosikan ke orbital 3d.
Selanjutnya orbital 3s , ketiga orbital 3p, dan 1 orbital 3d mengalami
hibridisasi membentuk orbital hibrida sp3d yang berbentuk bipiramida
trigonal.
15P : [Ne] 3s2 3p3 3d0
Promosi menjadi
15P : [Ne] 3s1 3p3 3d1
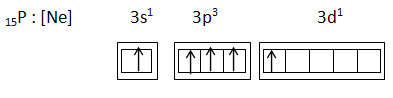 Hibridisasi dari atom P pada PCl5 adalah sp3d1.
Hibridisasi dari atom P pada PCl5 adalah sp3d1.
No comments:
Post a Comment