H2 (g) + Cl2 (g) → 2 HCl
Rekasi hidrogen dan klorin dalam bentuk gas tidak melibatkan elektron tetapi terjadi dan membentuk ikatan kovalen antaa dua unsur tersebut. Coba sobat ingat lagi tentang konsep ikatan ion dan ikatan kovalen. Dari problem itulah kemudian muncul konsep lain dari reaksi redoks yang dikaitkan dengan namanya bilangan oksidasi.
Apa itu Bilangan Oksidasi?
Bilangan oksidasi dapat didefinisikan
sbagai muatan tidak nyata (imajiner) suatu atom dalam senyawa yang
didasarkan pada distributsi elektron di sekitar atom tersebut yang
diperhitungkan berdasarkan elektronegativitas. Mudahnya sobat bisa
bilang bilangan oksidasi (biloks) muatan yang seolah-olah dimiliki oleh
sebuah atom. Dalam konsep bilangan oksidasi ada dua hal penting yang
harus sobat perhatikan
- Distribusi elektron di antara kedua atom yang sama tingkat elektronegativitasnya dianggap sama
- Sebaliknya distribusi elektron di antara kedua atom yang berbeda maka elekgtronnya dianggap milik unsur yang punya elektronegativitas lebih tinggi.
Bagiman Menentukan Bilangan Oksidasi?
Menentukan suatu atom punya bilangan
oksidasi positif (+) atau (-) tergantung pada elekronegativitas dari
masing-masing unsur. Jika suatu unsur berikatan dengan yang lain dan
membentuk ion atau senyawa maka unsur yang punya elektronegativitas
lebih kecil akan memiliki bilangan oksidasi positif (+) sebaliknya unsur
yang memiliki elektronegativitas yang lebih tinggi akan memiliki biloks
negatif (-). Untuk mengingat lagi tentan elektronegativitas dari
beberapa atom coba sobat simak key text berikut
Unsur Logam < H < P < C < S < I < Br < Cl < N < O < F
Buat mengingat lagi tentang keelektronegatifan silahkan baca sifat periodik unsur. Yuk sobat kita buat menambah pemahaman, kita ngulik bentar contoh berikut
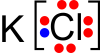
Contoh 1Berapa Bilangan Oksidasi K dan Cl dalam senyawa Kalium Klorida?
Karena ikatannya adalah ikatan ion dengan struktur lewis
maka K melepas 1 elektron kepada Cl
(menurut konsep pertukaran elektron maka kalau melepas berarti biloksnya
positif yang menerima negatif), sehingga di dapat bilangan oksidasi K =
+1 dan Cl = -1.
Contoh 2
Berapa Bilangan Oksidasi pada senyawa ari murni (H2O)?
rumus lewis dari H2O
Berapa Bilangan Oksidasi pada senyawa ari murni (H2O)?
rumus lewis dari H2O
Menurut keytext di atas O lebih
elektronegatif dibandingkan dengan H, sehingga elektron ikatan
didistribusikan pada atom O yang notabenya lebih negatif. Jadi biloks O =
-2 dan H = +1
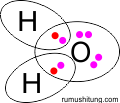
No comments:
Post a Comment